- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:34.
- Naposledy změněno 2025-06-01 07:36.
Klíčový rozdíl mezi kyanohydrinem a nitrilem je v tom, že kyanohydrinové sloučeniny obsahují kyanoskupinu a hydroxyskupinu, zatímco nitrilové sloučeniny obsahují pouze kyanoskupiny.
Kyanhydrinové i nitrilové sloučeniny obsahují kyanoskupiny (funkční skupina -CN). Tyto sloučeniny mají tyto funkční skupiny připojené k alkylové nebo arylové skupině; proto je můžeme kategorizovat jako organické sloučeniny.
Co je kyanhydrin?
Kyanhydrin je organická sloučenina, která má obecný chemický vzorec R2C(OH)CN. Tyto sloučeniny mají dvě funkční skupiny na molekulu: kyanoskupinu a hydroxyskupinu. Tyto dvě funkční skupiny jsou připojeny ke stejnému atomu uhlíku. Tento atom uhlíku je dále připojen buď k alkylové nebo arylové skupině, nebo mohou existovat oba typy skupin R.
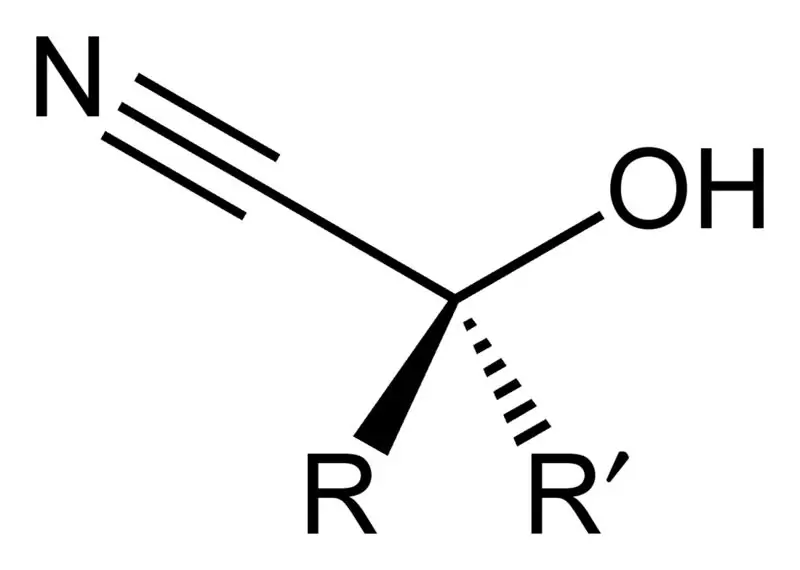
Průmyslově jsou kyanohydrinové sloučeniny důležité jako prekurzory pro výrobu karboxylových kyselin a také některých aminokyselin. Tyto kyanhydrinové sloučeniny vznikají kyanohydrinovou reakcí, při které se keton nebo aldehyd zpracuje s kyanovodíkem (HCN) v přítomnosti kyanidu sodného v nadměrném množství jako katalyzátoru. Během této produkční reakce působí kyanoskupina (CN-) kyanovodíku jako nukleofil, který napadá elektrofilní karbonylový uhlík v ketonu nebo aldehydu. Po této reakci následuje protonace pomocí HCN, která vede k regeneraci kyanidového aniontu. Kyanohydriny však můžeme připravit i vytěsněním siřičitanu kyanidovými solemi.
Nejběžnější a nejdůležitější kyanohydrinovou sloučeninou je acetonkyanohydrin. Je to kyanohydrin acetonu vzniklý jako meziprodukt při průmyslové výrobě methylmethakrylátu. Tato látka existuje jako kapalina a může sloužit jako zdroj HCN.
Co je nitril?
Nitrilové sloučeniny jsou organické sloučeniny, které mají obecný chemický vzorec R-CN. To znamená, že tyto sloučeniny mají kyanoskupinu. Proto se termín kyano- v průmyslových aplikacích obvykle používá zaměnitelně s termínem nitril. Existuje mnoho důležitých aplikací nitrilových sloučenin, včetně tvorby methylkyanoakrylátu, při výrobě superglue, nitrilkaučuku, polymerů obsahujících nitril, které jsou užitečné při výrobě lékařských rukavic atd. Existuje také mnoho aplikací nitrilkaučuku; zejména jako automobilová a jiná těsnění díky své odolnosti vůči palivu a oleji. Ještě důležitější je, že anorganické sloučeniny obsahující kyanoskupinu se nenazývají nitrilové sloučeniny; místo toho se jim říká kyanidy.

Když vezmeme v úvahu strukturu, nitrily jsou lineární molekuly. Tyto molekuly odrážejí sp hybridizaci atomu uhlíku s trojnou vazbou s atomem dusíku. Nitrilové sloučeniny jsou polární a mají dipólový moment. Nitrilové sloučeniny se vyskytují jako kapaliny, které mají vysokou relativní permitivitu.
Nitrilové sloučeniny můžeme vyrábět průmyslově prostřednictvím ammoxidace a hydrokyanace. Obě tyto trasy jsou udržitelné (zelené) a mají minimální únik nebezpečných látek.
Jaký je rozdíl mezi kyanohydrinem a nitrilem?
Kyanhydrinové a nitrilové sloučeniny jsou organické sloučeniny obsahující kyanofunkční skupinu. Klíčový rozdíl mezi kyanohydrinem a nitrilem je v tom, že kyanohydrinové sloučeniny obsahují kyanoskupinu a hydroxyskupinu, zatímco nitrilové sloučeniny obsahují pouze kyanoskupiny. Kromě toho se kyanohydrin vyrábí kyanohydrinovou reakcí, zatímco nitril lze vyrábět ammoxidací a hydrokyanací.
V infografikách níže jsou uvedeny další rozdíly mezi kyanohydrinem a nitrilem.
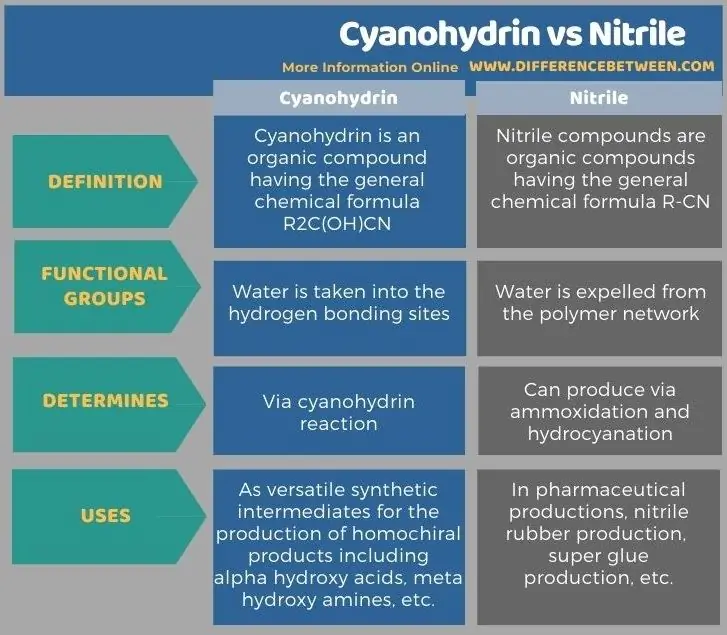
Shrnutí - kyanohydrin vs nitril
Kyanhydrinové a nitrilové sloučeniny jsou organické sloučeniny obsahující kyanofunkční skupinu. Klíčový rozdíl mezi kyanohydrinem a nitrilem je v tom, že kyanohydrinové sloučeniny obsahují kyanoskupinu a hydroxyskupinu, zatímco nitrilové sloučeniny obsahují pouze kyanoskupiny.






